Petir adalah suatu kejadian alam yang luar biasa, karena dalam setiap kejadiannya energi yang dilepaskan lebih besar daripada yang dihasilkan oleh seluruh pusat pembangkit tenaga listrik di Amerika. Cahaya yang dikeluarkan oleh petir lebih terang daripada cahaya 10 juta bola lampu pijar berdaya 100 watt. Hal lain yang menakjubkan bahwa molekul-molekul nitrogen, yang sangat penting untuk tumbuhan, muncul dari kekuatan ini.
Mengapa petir dapat membebaskan energi? Darimana petir mendapatkan energi listrik?
Berapa biaya listrik yang dapat kita hemat jika kita dapat mengumpulkan energi dari petir?
Saat kita merenungi semua perihal petir ini, kita dapat memahami bahwa peristiwa alam ini adalah sesuatu yang menakjubkan. Bagaimana sebuah kekuatan luar biasa semacam itu muncul dari partikel bermuatan positif (proton) dan negatif (elektron) dari dalam sebuah atom, yang tak terlihat oleh mata telanjang. Perbedaan jumlah proton dan elektron dalam sebuah atom mengakibatkan atom bermuatan listrik. Karena semua benda tersusun oleh atom-atom, maka perubahan muatan listrik pada atom akan mengakibatkan perubahan listrik pada benda.
Setiap benda memiliki kecenderungan untuk berada dalam keadaan netral, oleh karena itu jika benda bermuatan maka secara spontan dapat membebaskan muatannya. Salah satu contohnya adalah petir. Sifat-sifat muatan listrik antara lain: 1) listrik terdiri dari dua jenis muatan yaitu muatan positif dan negatif, 2)muatan listrik akan saling berinteraksi, muatan sejenis tolak menolak dan muatan tidak sejenis tarik-menarik. Para ahli berusaha memanfaatkan muatan listrik statis untuk berbagai keperluan dalam kehidupan sehari-hari.
Bagaimana Benda dapat Bermuatan Listrik?
Setiap zat tersusun atas atom-atom, dengan demikian muatan listrik suatu zat tergantung dari jenis muatan listrik atom-atomnya. Jika atom-atom benda lebih cenderung melepaskaan elektron, maka zat yang disusunnya lebih cenderung bermuatan positif. Sebaliknya jika atom-atom benda lebih cenderung menangkap elektron, maka zat yang disusunnya cenderung bermuatan negatif. Dengan demikian muatan listrik sebuah benda sangat tergantung dengan muatan listrik atom-atom penyusunnya.
Bagaimana cara membuat benda bermuatan listrik?
Suatu benda dapat dimuati listrik dengan dua cara yaitu:
1. Menggosok
a. Menggosok penggaris plastik dengan kain wool --> Penggaris menjadi bermuatan listrik jenis negatif.
b. Menggosok kaca dengan kain sutera --> Kaca menjadi bermuatan listrik jenis positif.
Mengapa dengan menggosokkan benda ke benda lain dapat membuat benda bermuatan listrik? Apakah semua benda jika digosokkan akan bermuatan listrik?
Muatan listrik pada sebuah benda, sangat dipengaruhi olah muatan listrik atom-atom penyusunnya. Ada atom-atom yang cenderung melepas elektron, tetapi ada juga atom-atom yang cenderung mengikat elektron. Jika dua benda tersusun dari atom-atom yang memiliki perbedaan sifat tersebut saling digosokkan maka, maka interaksi itu akan lebih mudah membuat benda bermuatan listrik.
Dari animasi di atas. Jika kain sutera digosokkan pada kaca, maka elektron-elektron kaca akan berpindah menuju sutera, sehingga kaca menjadi bermuataan positif. sementara itu kain sutera menjadi bermuatan negatif karena mendapat tambahan elektron.
Jika kain wool digosokkan pada plastik, maka elektron-elektron kain wool akan berpindah menuju plastik, sehingga plastik menjadi bermuataan negatif. sementara itu kain wool menjadi bermuatan positif karena kehilangan elektron-elektronnya.
2. Induksi
Bagaimana proses pemuatan listrik dengan induksi?
Induksi dapat dilakukan dengan cara mendekatkan benda yang bermuatan listrik ke benda netral. Akibatnya benda netral akan terpolarisasi. Jika benda netral yang telah terpolarisasi di hubungkan dengan tanah (di ground kan), maka elektron-elektronnya akan mengalir menuju tanah. Setelah penghantar yang menuju tanah di hilangkan dan benda bermuatan listrik dijauhkan, maka benda netral akan menjadi kekurangan elektron (bermuatan positif). Induksi dalam jumlah muatan tertentu dapat mengakibatkan muatan listrik melompati gap (jarak pemisah), dalam hal ini dapat menimbulkan lintasan bunga api. Salah satu peristiwa yang besar adalah terjadinya petir.
Sifat Muatan Listrik --> Muatan listrik dapat menarik benda-benda kecil
Potongan kertas kecil-kecil dapat menempel pada penggaris yang bermuatan listrik karena adanya gaya listrik. Jika gaya listrik lebih besar dari gaya gravitasi benda maka benda akan menempel pada penggaris, sebaliknya jika gaya listrik kurang dari gaya gravitasi, maka benda tidak akan menempel.
Interaksi antara dua muatan listrik baik berupa gaya tolak atau gaya tarik dapat digambarkan dengan menggunakan garis-garis gaya listrik berikut:
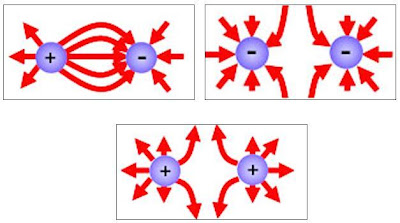
Tags: Listrik Statis, Muatan Listrik, Medan Listrik, Energi Listrik, Cara membuat benda bermuatan listrik.
Tahukah kamu bahwa sebagian besar bahan makanan dan minuman yang kita konsumsi sehari-hari bersifat asam, basa, atau garam? Pernahkah kamu makan semangkuk baso atau soto yang telah diberi cuka? Bagaimanakah rasanya? Apakah cuka tersebut tergolong larutan asam? Apa ciri-ciri larutan yang bersifat asam, basa, atau garam? Bagaimana cara menguji suatu larutan itu tergolong asam, basa atau garam? Mari kita pelajari bersama.
Bagaimana rasa permen vitamin C atau kuah bakso yang diberi cuka? Tentu kamu akan menjawab rasanya masam. Pernahkah kamu mencicipi garam? Bagaimana rasanya? Bagaimanakah rasa jamu? Rasanya pahit atau manis? Rasa pahit merupakan salah satu sifat zat yang bersifat basa.
Memang, sejak zaman dahulu asam, basa, dan garam sudah dikenal, karena banyak bahan makanan atau minuman yang digunakan dalam kehidupan sehari-hari bersifat asam, basa atau garam. Coba kamu sebutkan contoh bahan makanan atau minuman yang bersifat asam. Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti cuka. Seperti diketahui, zat utama dalam cuka adalah asam asetat. Basa (alkali) berasal dari bahasa Arab yang berarti abu.
Apakah sifat asam, basa, dan garam itu? Coba kamu perhatikan larutan pembersih porselin atau keramik. Apa yang terjadi jika larutan pembersih tersebut terkena lantai keramik? Coba kamu simpulkan sifat-sifat asam!
Pernahkah kamu mencuci dengan deterjen atau sabun? Apa yang kamu rasakan pada tanganmu itu? Apakah licin dan terasa panas? Seperti halnya dengan sabun, basa bersifat kaustik (licin), selain itu basa juga bersifat alkali (bereaksi dengan protein di dalam kulit sehingga sel-sel kulit akan mengalami pergantian).
Kita dapat mengenali asam dan basa dari rasanya. Namun, kita dilarang mengenali asam dan basa dengan cara mencicipi karena cara tersebut bukan merupakan cara yang aman. Bagaimanakah cara mengidentifikasi asam dan basa yang baik dan aman? Kamu dapat mengenali asam dan basa dengan menggunakan indikator. Indikator yaitu suatu bahan yang dapat bereaksi dengan asam, basa, atau garam sehingga akan menimbulkan perubahan warna.
1. Asam
Kamu sudah mengetahui jika asam merupakan salah satu penyusun dari berbagai bahan makanan dan minuman, misalnya cuka, keju, dan buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen. Tahukah kamu perbedaan antara ion, kation, dan anion? Ion adalah atom atau sekelompok atom yang bermuatan listrik. Kation adalah ion yang bermuatan listrik positif. Adapun anion adalah ion yang bermuatan listrik negatif.
Sifat khas lain dari asam adalah dapat bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik. Reaksi antara asam dengan logam bersifat korosif. Contohnya, logam besi dapat bereaksi cepat dengan asam klorida (HCl) membentuk Besi (II) klorida (FeCl2).
Berdasarkan asalnya, asam dikelompokkan dalam 2 golongan, yaitu asam organik dan asam anorganik. Tahukah kamu apa bedanya? Asam organik umumnya bersifat asam lemah, korosif, dan banyak terdapat di alam. Asam anorganik umumnya bersifat asam kuat dan korosif. Karena sifat-sifatnya itulah, maka asam-asam anorganik banyak digunakan di berbagai kebutuhan manusia.
2. Basa (Hidroksida)
Jika kamu mencuci tangan dengan sabun, apa yang kamu rasakan pada tanganmu? Dalam keadaan murni, basa umumnya berupa kristal padat dan bersifat kaustik. Beberapa produk rumah tangga seperti deodoran, obat maag (antacid) dan sabun serta deterjen mengandung basa.
Basa adalah suatu senyawa yang jika dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-). Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH. Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida.
3. Garam
Jika mendengar kata ”garam”, pastilah yang terbayang pada benakmu adalah garam dapur. Garam dapur memang merupakan salah satu contoh garam. Dalam kehidupan sehari-hari pernahkah kamu melihat orang yang sakit perut (maag dan sejenisnya)? Tahukah kamu mengapa orang yang sakit maag minum obat sakit maag atau antacid? Apakah antacid itu?
Orang mengalami sakit perut disebabkan asam lambung yang meningkat. Untuk menetralkan asam lambung (HCl) digunakan antacid. Antacid mengandung basa yang dapat menetralkan kelebihan asam lambung (HCl). Umumnya zat-zat dengan sifat yang berlawanan, seperti asam dan basa cenderung bereaksi membentuk zat baru. Bila larutan asam direaksikan dengan larutan basa, maka ion H+ dari asam akan bereaksi dengan ion OH- dari basa membentuk molekul air disebut reaksi penetralan.
Apakah terjadi reaksi antara ion negatif dari asam dan ion positif logam dari basa? Ion-ion ini akan bergabung membentuk senyawa ion yang disebut garam. Bila garam yang terbentuk ini mudah larut dalam air, maka ion-ionnya akan tetap ada di dalam larutan. Tetapi jika garam itu sukar larut dalam air, maka ion-ionnya akan bergabung membentuk suatu endapan. Jadi, reaksi asam dengan basa disebut juga reaksi penggaraman karena membentuk senyawa garam.
Walaupun reaksi asam dengan basa disebut reaksi penetralan, tetapi hasil reaksi (garam) tidak selalu bersifat netral. Sifat asam basa dari larutan garam bergantung pada kekuatan asam dan basa penyusunnya netral, disebut garam normal, contohnya NaCl dan KNO3. Garam yang berasal dari asam kuat dan basa lemah bersifat asam dan disebut garam asam, contohnya adalah NH4 Cl. Garam yang berasal dari asam lemah dan basa kuat bersifat basa dan disebut garam basa, contohnya adalah CH3COONa. Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH, Ca(OH)2 termasuk basa kuat.
4. Larutan Asam, Basa, dan Garam Bersifat Elektrolit
Pernahkah kamu melihat seseorang mencari ikan dengan menggunakan ”setrum” atau aliran listrik yang berasal dari aki? Apa yang terjadi setelah beberapa saat ujung alat yang telah dialiri arus listrik itu dicelupkan ke dalam air sungai? Ternyata ikan yang berada di sekitar ujung alat itu terkena aliran listrik dan pingsan atau mati.
Apakah air dapat menghantarkan listrik? Sebenarnya air murni adalah penghantar listrik yang buruk. Akan tetapi bila dilarutkan asam, basa, atau garam ke dalam air maka larutan ini dapat menghantarkan arus listrik. Zat-zat yang larut dalam air dan dapat membentuk suatu larutan yang menghantarkan arus listrik dinamakan larutan elektrolit. Contohnya adalah larutan garam dapur dan larutan asam klorida. Zat yang tidak menghantarkan arus listrik dinamakan larutan nonelektrolit. Contohnya adalah larutan gula dan larutan urea.
Untuk mengetahui suatu larutan dapat menghantarkan arus listrik atau tidak, dapat diuji dengan alat penguji elektrolit. Alat penguji elektrolit sederhana terdiri dari dua elektroda yang dihubungkan dengan sumber arus listrik searah dan dilengkapi dengan lampu, serta bejana yang berisi larutan yang akan diuji. Mari kita lakukan kegiatan berikut untuk mengetahui apakah asam, basa, dan garam dapat menghantarkan arus listrik.
Rumus kimia adalah rumus yang menyatakan lambang atom dan jumlah atom unsur yang menyusun senyawa. Rumus kimia disebut juga rumus molekul, karena penggambaran yang nyata dari jenis dan jumlah atom unsur penyusun senyawa yang bersangkutan.
Berbagai bentuk rumus kimia sebagai berikut:
1. Rumus kimia untuk molekul unsur monoatomik.
Rumus kimia ini merupakan lambang atom unsur itu sendiri.
Contoh : Fe, Cu, He, Ne, Hg.
2. Rumus kimia untuk molekul unsur diatomik.
Rumus kimia ini merupakan penggabungan dua atom unsur yang sejenis dan saling berikatan.
Contoh : H2, O2, N2, Cl2, Br2, I2.
3. Rumus kimia untuk molekul unsur poliatomik.
Rumus kimia ini merupakan penggabungan lebih dari dua atom unsur yang sejenis dan saling berikatan.
Contoh : O3, S8, P4.
4. Rumus kimia untuk molekul senyawa ion
Merupakan rumus kimia yang dibentuk dari penggabungan antar atom yang bermuatan listrik, yaitu ion positif (kation) dan ion negatif (anion). Ion positif terbentuk karena terjadinya pelepasan elektron (Na+, K+, Mg2+), sedangkan ion negatif terbentuk karena penangkapan elektron (Cl-, S2-, SO42-).
Penulisan rumus kimia senyawa ion sebagai berikut.
-Penulisan diawali dengan ion positif (kation) diikuti ion negatif (anion).
-Pada kation dan anion diberi indeks, sehingga didapatkan senyawa yang bersifat netral (jumlah muatan (+) = jumlah muatan (-)).
-Bentuk umum penulisannya sebagai berikut.
Contoh :
Na+ dengan Cl- membentuk NaCl.
Mg2+ dengan Br- membentuk MgBr2.
Fe2+ dengan SO42- membentuk FeSO4.
5. Rumus kimia untuk senyawa biner nonlogam dengan nonlogam.
Penulisan rumus kimia ini berdasarkan kecenderungan atom yang bermuatan positif diletakkan di depan, sedangkan kecenderungan atom bermuatan negatif diletakkan di belakang menurut urutan atom berikut ini.
B – Si – C – S – As – P- N – H – S – I – Br – Cl – O – F
Contoh : CO2, H2O, NH3.
6. Rumus kimia /rumus molekul senyawa organik.
Rumus ini juga menunjukkan jenis dan jumlah atom penyusun senyawa organik yang berdasarkan gugus fungsi masing – masing senyawa.
Contoh :
CH3COOH : asam asetat
CH4 : metana (alkana)
C2H5OH : etanol (alkohol)
7. Rumus kimia untuk senyawa anhidrat.
Anhidrat merupakan sebutan dari garam tanpa air kristal (kehilangan molekul air kristalnya) atau H2O.
Contoh :
CaCl2 anhidrous atau CaCl2.2H2O.
CuSO4 anhidrous atau CuSO4.5H2O.
8. Rumus kimia untuk senyawa kompleks.
Penulisan rumus senyawa dan ion kompleks ditulis dalam kurung siku [...].
Contoh :
Na2[MnCl4]
[Cu(H2O)4](NO3)2
K4[Fe(CN)6]
RUMUS EMPIRIS
Rumus empiris merupakan rumus kimia yang menyatakan jenis dan perbandingan paling sederhana (bilangan bulat terkecil) dari atom – atom penyusun senyawa.
Contoh :
C12H22O11 (gula)
CH2O (glukosa)
C2H6O (alkohol)
CHO2 (asam oksalat)
RUMUS STRUKTUR
Rumus struktur merupakan rumus kimia yang menggambarkan posisi atau kedudukan atom dan jenis ikatan antar atom pada molekul.
Rumus struktur secara singkat dituliskan :
CH3CH3
CH3COOH
RUMUS BANGUN/BENTUK MOLEKUL
Adalah rumus kimia yang menggambarkan kedudukan atom secara geometri/ tiga dimensi dari suatu molekul.
Zat Adalah sesuatu yang memiliki massa dan menempati ruang. Zat bisa berupa zat padat, zat cair dan zat gas. Zat berdasarkan kemurniannya dapat dibagi lagi menjadi tiga, yaitu :
A. Unsur
Unsur adalah suatu zat yang sudah tidak bisa dibagi-bagi lagi menjadi bagian yang lebih kecil.
Contoh unsur :
- Unsur Emas / Au (Aurum)
- Unsur Nitrogen / N
- Unsur Platina / Pt
- Unsur Karbon / Carbon / C
B. Senyawa
Senyawa adalah zat tunggal yang terdiri atas beberapa unsur yang saling kait-mengait.
Contoh Senyawa :
- Senyawa Oksigen / O2
- Senyawa Air / H2O
- Senyawa Alkohol / C2 H5 OH
- Senyawa Garam Dapur / NaCl
C. Campuran
Campuran adalah zat yang tersusun dari beberapa zat yang lain jenis dan tidak tetap susunannya dari unsur dan senyawa.
Contoh Campuran :
- Udara
- Tanah
- Air
Persamaan garis lurus dapat ditulis dalam bentuk y = mx + c dengan m dan c suatu konstanta. Persamaan garis yang melalui titik (0, c) dan sejajar garis y = mx adalah y = mx + c. Langkah-langkah menggambar grafik persamaan y = mx atau y = mx + c sebagai berikut:
– Tentukan dua titik yang memenuhi persamaan garis tersebut dengan membuat tabel untuk mencari koordinatnya.
– Gambar dua titik tersebut pada bidang koordinat Cartesius.
– Hubungkan dua titik tersebut, sehingga membentuk garis lurus yang merupakan grafik persamaan yang dicari.
Gradien suatu garis adalah bilangan yang menyatakan kecondongan suatu garis yang merupakan perbandingan antara komponen y dan komponen x. Garis dengan persamaan y = mx memiliki gradien m dan melalui titik (0, 0). Garis dengan persamaan y = mx + c memiliki gradien m dan melalui titik (0, c). Garis dengan persamaan ax + by + c = 0 memiliki gradien (-a/b).
Gradien garis yang melalui titik (x1, y1) dan (x2, y2) adalah (y2-y1)/(x2-x1). Gradien garis yang sejajar sumbu X adalah nol. Gradien garis yang sejajar sumbu Y tidak didefinisikan. Garis-garis yang sejajar memiliki gradien yang sama. Hasil kali gradien dua garis yang saling tegak lurus adalah –1.
Persamaan garis yang melalui titik (x1, y1) dan bergradien m adalah y – y1 = m(x – x1). Persamaan garis yang melalui titik (x1, y1) dan sejajar garis y = mx + c adalah y – y1 = m(x – x1). Persamaan garis yang melalui titik (x1, y1) dan tegak lurus garis y = mx + c adalah y – y1 = (-1/m)(x – x1).
Persamaan garis yang melalui dua titik dapat diselesaikan dengan substitusi ke fungsi linear y = ax + b. Persamaan garis yang melalui titik A(x1, y1) dan B(x2, y2)
adalah (y-y1)/(y2-y1)=(x-x1)/(x2-x1)
Fenomena “nanowires” yang tergambarkan dengan jelas untuk pertama kalinya berhasil diamati dari pengamatan atas mikro-organisme Shewanella oneidensis strain MR-1 yakni suatu jenis bakteri berujud serupa untaian rambut yang berkemampuan menyalurkan listrik sepanjang juluran batang untaian rambut tersebut, hal yang mungkin tampaknya memainkan peranan kunci dalam proses respirasi pada kejadian terlontarkannya elektron keluar jauh dari sel.
Respirasi terjadi dalam proses metabolisme dimana sejumlah organisme dalam tubuh memperoleh energi dari molekul organik yang prosesnya terjadi dalam sel dan jarinqan dalam tubuh ketika energi dan qas CO2 (carbon dioxide) dilepaskan dan diserap oleh darah guna disalurkan ke organ paru-paru.
Fenomena yang sering disebut sebagai karakteristik “conductive pili” atau “nanowires” yakni kemampuan dari ujud mikro-organisme dalam sel untuk menghantarkan muatan listrik dalam tatanan proses metabolisme. Keberhasilan riset pengamatan atas Shewanella oneidensis strain MR-1 yang dilakukan oleh ahli biofisika Moh El-Naggar dari University of Southern California dipublikasikan dalam journal ilmiah Proceedings of the National Academy of Sciences terbitan mid Oktober yl.
Berbeda halnya dalam proses respirasi dengan aktivasi zat oksigen yang berlangsungnya proses difusi dengan melalui proses pertukaran elektron melewati membran sel; maka untuk golongan bakteri sosok mikro-organisme Shewanella oneidensis MR-1 dalam jalannya proses respirasi diketahui berkemampuan menghantarkan energi dengan melewati sebentuk zat padat / solid non-organik ---metal oxide--- sebagai penerima elektron (electron acceptors). Sehingga oleh karenanya kalangan ahli meyakini bahwa diperlukan suatu jalan mekanisme lain dalam menyalurkan pelepasan elektron keluar hingga mencapai zat solid yang jauh diluar dari membran sel. Dan bagi kalangan ahli riset terkini mikrobiologi salah satu karakteristik yang ditengarai berkerakteristik cocok demikian adalah “nanowires” yang melekat pada sejumlah sel mikro-organisme.
Dalam riset yang dilakukan Moh El-Naggar dkk. menumbuhkan bakteri Shewanella oneidensissedemikian rupa dalam kondisi untuk menjadikan teramatinya produksi nanowires yang melimpah serta dengan membatasi sedemikian rupa keberadaan zat metal berkarakter electron acceptors. Eksperimen pun kemudian mengaplikasikan perangkat pemindai voltase listrik. Pengamatan menunjukkan adanya arus listrik yang tersalurkan dalam konfigurasi ini. Demikian halnya ketika juluran sel nanowires disisihkan maka aliran arus listrik pun menghilang. Penelitian ini bahkan berhasil pula untuk pertama kalinya melakukan pengukuran atas besaran nominal arus listrik yang mengalir.
Akan halnya keberhasilan riset yang untuk pertama kalinya berhasil dengan amat jelas proses kejadian fenomena nanowires berikut pemindaian atas besaran arus listrik yang terjadi menjadikannya sebagai sebuah penemuan penting bagi kajian riset terapan terkini bidang mikrobilogi. Apresiasi tertinggi akan pentingnya penemuan riset ini diungkapkan oleh kolega ilmuwan peneliti ahli mikrobiologi yakni; Gemma Reguera dari Michigan State University dan Derek Lovley dari University of Massachusetts seraya mengimbuhkan temuan riset yang membuktikan adanya arus listrik dari fenomena nanowires dalam tatanan mikroorganisme ini sebagai hasil yang menakjubkan : “fascinating...” !
Google Sites adalah sebuah wiki terstruktur yang ditawarkan oleh Google sebagai bagian dari Google Apps. Ini diluncurkan pada tanggal 28 Februari 2008. Ini menggantikan Google Page Creator,halaman Web sebelumnya layanan Google penciptaan.
Beberapa hari yang lalu mencoba membuat site di google. Anda bisa mencoba
disini. Namun ada beberapa kendala yang dialami oleh beberapa orang yang mencoba membuat site di google,dapat anda lihat di forum google
disini. Termasuk saya sendiri mengalami kesulitan waktu mencoba membuat site di google site.
Nama yang saya coba pilih adalah sebagai berikut:
- rssreader
- rssfolder
- rssprovider
Namun pesan error yang sama selalu muncul yaitu:
“the URL is unavailable,or that the location is unavailable”.
Verifying Pingbacks and TrackbacksComments on blogs are often criticized as lacking authority,since anyone can post anything using any name they like:there’s no verification process to ensure that the person is who they claim to be. Trackbacks and Pingbacks both aim to provide some verification to blog commenting.
Comment Moderation
Comment Moderation is a feature which allows the website owner and author to monitor and control the comments on the different article posts,and can help in tackling comment spam. It lets you moderate comments,&you can delete unwanted comments,approve cool comments and make other decisions about the comments.
Comment Spam
Comment Spam refers to useless comments (or trackbacks,or pingbacks) to posts on a blog. These are often irrelevant to the context value of the post. They can contain one or more links to other websites or domains. Spammers use Comment Spam as a medium to get higher page rank for their domains in Google,so that they can sell those domains at a higher price sometime in future or to obtain a high ranking in search results for an existing website.















0 komentar: